le Paludisme en Côte d'Ivoire
- Profil épidémiologique
- Parasites du paludisme
Distribution des parasites
Les données d’études récentes (enquête MICS 2016, rapports PNLP 2018) ne relèvent pas de variations particulières dans la répartition des espèces plasmodiales rencontrées dans le pays. Plasmodium falciparum demeure toujours l’espèce prédominante. Il est en cause dans plus de 95% des cas. Toutefois, d’autres espèces sont rencontrées en Côte d’Ivoire dans moins de 5% des cas. Il s’agit de Plasmodium malariae et Plasmodium ovale et plus rarement Plasmodium vivax.
Résistances des parasites et tolérance des CTA
En Côte d’Ivoire, seule la résistance de Plasmodium falciparum a été étudiée dans plusieurs études. Après l’adoption des CTA dans les directives nationales en 2005, la recherche de la résistance aux CTA utilisées quotidiennement dans le pays a été initié depuis 2009 dans les sites sentinelles. Aussi en 2013, les premières enquêtes ont estimé à 65% la Chloroquino-résistance (Pénali et al. 2013)
D’après les derniers résultats publiés en 2019 sur ces sites (Rapport PNLP 2018), l’Artésunate-Amodiaquine et l’Artéméther-Luméfantrine gardent toujours un taux d’efficacité thérapeutique de 95% après correction PCR. Le TET conduit dans les 12 sites sentinelles a montré une bonne efficacité et une bonne tolérance des CTA (ASAQ et AL). Le taux de succès cumulé à J28 a été de 100% avec l’ASAQ sur les sites d’Abengourou, Korhogo, Man, San-Pedro et Yamoussoukro. Avec l’AL, ce taux a varié de 94,6% à 100% à J28. Aucun échec thérapeutique précoce n’a été observé dans les différents sites avec les deux médicaments. Des cas de recrudescences ont été observés sur les sites de Bouna et d’Adzopé. Aucun retard de clairance parasitaire n’a été observé sur l’ensemble des sites. Les deux CTA ont été bien tolérées. Une étude ciblant uniquement l’ASAQ chez 15 000 patients menée à Agboville en 2015, a montré un taux de tolérance de 97%. Seuls 2% des patients ont arrêté le traitement pour syndromes extrapyramidaux. Ces résultats sont en faveur du maintien des CTA dans la prise en charge du paludisme simple dans notre pays. Cependant, les recrudescences observées à Bouna et à Adzopé interpellent le PNLP à plus de vigilance dans la surveillance de l’efficacité des CTA en Côte d’Ivoire.
Vecteurs du paludisme
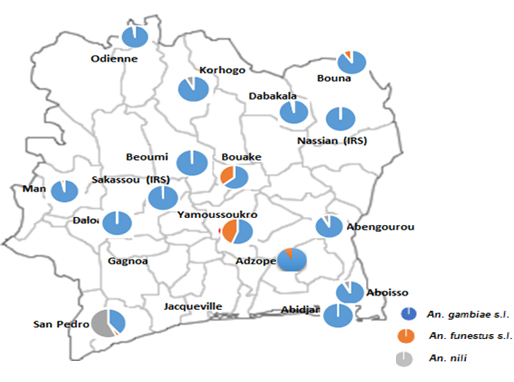
Figure 8 : Carte de la distribution des vecteurs majeurs du paludisme en Côte d’Ivoire (Source PMI/Vectorlink, 2018).
- Répartition spatiale des vecteurs
Le paludisme est transmis par trois complexes d’espèces vectorielles en Côte d’Ivoire : An. gambiae s.l., An. funestus s.l. et An. nili s.l. (Figure 8). L’An. gambiae s.l. représente l’espèce prédominante dans tous les sites de surveillance à l’exception de San Pedro où An.. nili est l’espèce vectrice majeure. L’An. funestus présente une abondance relativement forte à Yamoussoukro puis à Bouaké (Rapport GSA, 2019).
Les prévalences parasitaires les plus faibles sont retrouvées dans les régions sanitaires d’Abidjan et les plus élevées dans les régions du centre et de l’est du pays. (EPPA, 2016).
Les données d’études récentes ne relèvent pas de variations particulières dans la répartition des espèces plasmodiales rencontrées dans le pays. Le Plasmodium falciparum demeure toujours l’espèce prédominante. Il est retrouvé dans plus de 95% des cas et les espèces Plasmodium malariae et Plasmodium ovale sont rencontrées dans 5% des cas (Gbalégba et al., 2018).
Les données entomologiques récentes révèlent qu’ An. gambiae s.l. demeure toujours le vecteur principal avec un Taux d’Inoculation Entomologique (TIE) moyen mensuel de 13.0 piures infectantes par homme et par mois (pi/h/m) (PMI VectroLink 2018, Assouho et al, 2019, Rapport GSA 2019).
Ainsi, malgré plusieurs distributions de masse de MILDA et un taux d’utilisation de 63% (Enquête post campagne 2019), la transmission du paludisme reste élevée et hétérogène sur le territoire ivoirien (Assouho et al., 2019). C’est pourquoi le renforcement des autres stratégies de lutte antivectorielle (PID, LAL, Assainissement) en complément aux MILDA doit être encouragé (PMI Vectorlink, 2018).
- Bionomie des vecteurs
Le taux d’anthropophilie varie selon les espèces et les sites. Les études entomologiques menées en 2019 révèlent des taux élevés d’exophagie chez An. gambiae s.l. en milieu urbain à Abengourou (62%), à Adzopé (80%), à Aboisso (65%) et à Abidjan (55%). Cependant en milieu rural, de forts taux d’endophagie ont été notés pour ce vecteur à Aboisso (59%), à Bouna (65%), à San Pedro (65%) et à Man (55%) (Rapport GSA/PNLP, 2019). Ainsi, le comportement de piqûres varie selon le milieu : les vecteurs piquent de préférence à l’extérieur des habitations en milieu urbain et à l’intérieur des habitations en milieu rural.
En 2018, sur un échantillon de 4 709 moustiques collectés sur appât humain, 1 349 (62%), 1070 (67%), 76 (84%) et 668 (80%) étaient pares respectivement à Sakassou, Gagnoa, Bocanda et Jacqueville. Dans l’ensemble, le taux de parturité était similaire pour les moustiques collectés à l’intérieur et à l’extérieur (PMI Vectorlink, 2018). Les taux de parturité étaient plus élevés dans les zones rurales que dans les zones urbaines de Bocanda (89% contre 56%) et de Gagnoa (73% contre 63%), mais similaires dans les deux milieux à Sakassou (62% respectivement). Par ailleurs, seul le district de Jacqueville avait enregistré un taux de parturité plus élevé en zone urbaine (86%) qu'en zone rurale (75%), (PMI-Vectorlink, 2018).
- Résistance des vecteurs aux insecticides
En Côte d’Ivoire, le niveau de résistance du vecteur majeur, An. gambiae, aux insecticides utilisés pour l’imprégnation des moustiquaires varie selon les insecticides, les zones d’étude et les facies épidémiologiques du paludisme.
Une forte résistance aux pyréthrinoïdes a été observée dans tous les 15 sites (Abengourou, Aboisso, Adzopé, Beoumi, Bettié, Bouaké, Bouna, Dabakala, Daloa, Gagnoa, Nassian, Odienné, Sakassou, San-Pedro, Yamoussoukro) investigués pour la sensibilité d’ An. gambiae s.l..
La pré-exposition au PBO avant la deltaméthrine, perméthrine et l’alpha-cyperméthrine ne rétablit pas la sensibilité mais induit une augmentation significative de la mortalité des populations d’ An. gambiae s.l. dans la plupart des sites.
Le Chlorfénapyr, à la dose de 200 µg/bouteille a enregistré une sensibilité des vecteurs dans 09 sites (Figure 9a). La sensibilité à la clothianidine a été observée dans 07 sites y compris les deux sites ciblés pour la PID (Figure 9b). Des tests en bouteilles CDC utilisant du chlorfénapyr à des doses de 100 µg/bouteille et de 200 µg/bouteille ont montré une sensibilité d’An. gambiae s.l. dans 07 des 10 sites (Adzopé, Bocanda, Gagnoa, Daloa, Bouna, Aboisso et Bouaké), (PMI VectorLink, 2018).
Pour la clothianidine, les tests effectués dans 09 sites ont montré une sensibilité dans 07 sites et en particulier, tous les sites potentiels de la PID ont enregistré une sensibilité totale à l'insecticide (Figure 9c). Cela est important dans la mise en œuvre de la PID en tant que stratégie supplémentaire de lutte anti vectorielle (PMI VectorLink, 2018).
La sensibilité au pirimiphos-méthyl était observée dans 10 sites y compris Nassian, ce qui offre la possibilité de rotation avec le clothianidine au niveau de Nassian et l’extension dans les autres sites où les vecteurs sont sensibles au pirimiphos-méthyl. Les mutations kdr-Ouest et Est marqueurs de la résistance aux pyréthrinoïdes ont été trouvées chez An. gambiae s.l. dans tous les sites pour le kdr-Ouest à une fréquence très élevée (comprise entre 71 et 97%) et kdr-Est dans 06 des 10 sites, à l’exception de Bouaké, Bouna, Gagnoa et Jacqueville avec une fréquence comprise entre 5 et 10%. En outre, la mutation ace-1 qui est un marqueur de la résistance aux carbamates et aux organophosphorés, survient de manière concomitante avec toutes les mutations du gène kdr. Cette mutation a été trouvée dans tous les sites en dehors de Bouna avec des fréquences variant de 16 à 83% (PMI-VectorLink, 2018).
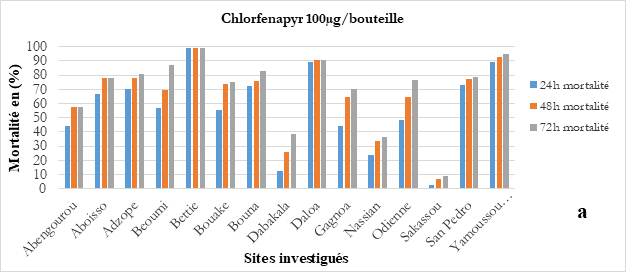
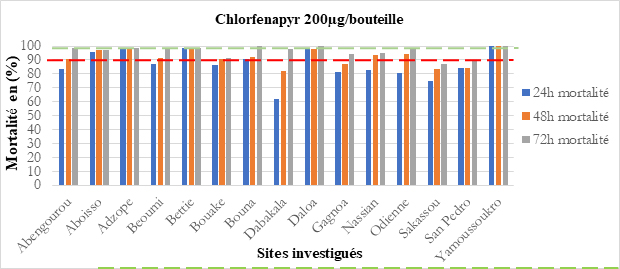
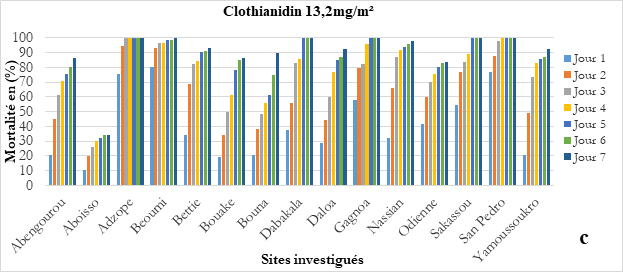
Figure 9 : Sensibilité d’An. gambiae s.l. (a) au Chlorfenapyr à 100 µg, (b), au Chlorfenapyr à 200 µg et (c) au Clothianidine 13,2 mg/m², par site.
Dans le cadre de la gestion de la résistance des vecteurs aux insecticides usuels, les études entomologiques réalisées ont permis de faire une stratification en fonction de la sensibilité des vecteurs. Ainsi, la distribution des MILDA aux ménages tiendra compte du type d’insecticide (figure 9 ci-dessous) :
- Deltaméthrine exclusivement dans 53 Districts Sanitaires ;
- Alpha-cyperméthrine exclusivement dans 9 Districts Sanitaires ;
- PBO exclusivement dans 9 Districts Sanitaires ;
- G2 exclusivement dans 12 Districts Sanitaires.
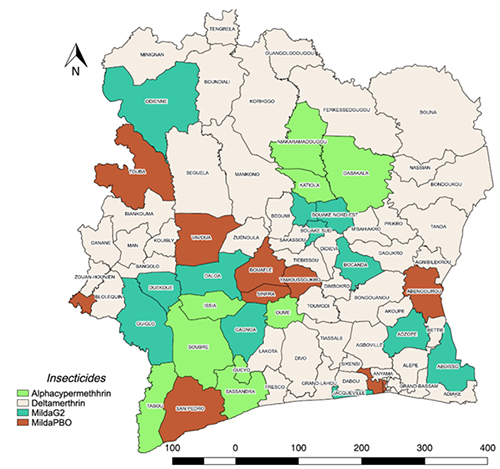
Figure 10 : Cartographie de la répartition des MILDA selon le type d’insecticide
Dynamique de la transmission du paludisme
La transmission du paludisme demeure stable toute l’année sur toute l’étendue du territoire avec des recrudescences en saison pluvieuse. Toutefois, cette dynamique de la transmission varie suivant les zones géoclimatiques comme suit :
- La zone Sud, région forestière avec une pluviométrie abondante (jusqu’à 1 800 mm) où la transmission du paludisme se fait dans les clairières mais également partout en raison de la déforestation largement avancée : les zones de transmission y sont de plus en plus importantes et elles durent quasiment toute l’année.
- La zone Nord, zone de savanes boisées où la transmission est permanente avec une recrudescence pendant les saisons de pluies qui durent 6 à 8 mois ;
- La zone centre de transition correspond à la zone pré-forestière où la durée de la transmission est comparable à celle de la zone forestière. On observe également des variations en fonction du faciès écologique rizicole ou non rizicole.
Stratification de la transmission du paludisme
La transmission du paludisme varie suivant les districts et cela en rapport avec les facteurs géo climatiques. Sur la base de l’incidence annuelle de 2018, le tableau ci-dessous présente la répartition de la population à risque de paludisme par strates.
Tableau V : Distribution de la population à risque de paludisme par strate
|
Strates |
Niveau de prévalence parasitaire |
Incidence annuelle |
Districts Sanitaires |
Population par strate en 2018 |
% population par strate |
|
Endémicité très faible |
|
< 200‰ |
Korhogo 2, Ouangolodougou |
491 316 |
2% |
|
Endémicité faible |
|
200 - 299‰ |
Dabou, Yopougon Ouest Songon, Abobo Est, Abobo Ouest, Anyama, Cocody Bingerville, Treichville Marcory, San Pedro, Sassandra, Grand Bassam, Boundiali, Kohogo1 |
4 257 449 |
17% |
|
Endémicité moyenne |
|
300 - 399‰ |
Jacqueville, Buyo, Gueyo, Méagui, Soubré, Tabou, Bettié, Aboisso, Adiaké, Minignan, Odienné, Touba, Oumé, Fresco, Guitry, Bocanda, M'bahiakro, Agboville, Akoupé, Alepé, Sikensi, Tiassalé, Bangolo, Blolequin, Guiglo, Kouibly, Toulepleu, Danané, Man, Zuenoula, Bouna |
7 546 396 |
30% |
|
Endémicité élevée |
|
400 - 499‰ |
Adjamé plateau attecoubé, Lakota, Didievi, Toumodi, Bongouanou, Daoukro, Dimbokro, Prikro, Duekoué, Vavoua, Sinfra, Bouaké Sud, Dabakala, Mankono, Yamoussoukro, Nassian |
4 477 686 |
18% |
|
Endémicité très élevée |
|
≥ 500‰ |
Grand lahou, yopougon Est, Koumassi port bouet Vridi, Abengourou, Agnibilekrou, Gagnoa, Divo, Tiebissou, Adzopé, Biankouma, Zouan hounien, Daloa, Issia, Bouaflé, Ferkessedougou, Tengrela, Béoumi, Bouaké nord Est, Bouaké Nord Oest, Sakassou, Katiola, Niakaramadougou, Seguela, Bondoukou, Tanda |
8 563 378 |
34% |
|
Pays |
37% |
|
|
25 336 225 |
100% |
Le paludisme demeure toujours endémique en Côte d’Ivoire avec la majorité de la population (81%) vivant dans les régions avec une incidence et cas estimés variant de 300‰ à plus de 500 ‰ habitants. De façon globale, on distingue 5 niveaux d’endémicité classés en niveau très faible, faible, modéré, élevé et très élevé, qui couvrent respectivement 2%, 17%, 30%, 18% et 34% de la population. Par ailleurs, les données de l’enquête de prévalence parasitaire du paludisme et de l’anémie chez les enfants âgés de 6 à 59 mois (EPPA 2016) révèlent une prévalence parasitaire moyenne de 37%.
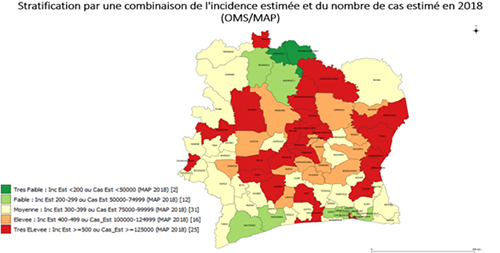
Figure 11 : Carte de la stratification par une combinaison de l’incidence estimée et du nombre de cas estimés en 2018 (OMS/MAP)
Tableau VI : Population par strates
|
Strates |
|||
|
Stratum 1 |
Rouge |
25 |
1 |
|
Stratum 2 |
Orange |
16 |
2 |
|
Stratum 3 |
Jaune |
31 |
3 |
|
Stratum 4 |
Vert clair |
12 |
4 |
|
Stratum 5 |
Vert foncé |
2 |
5 |
|
TOTAL |
86 |
Morbidité, mortalité et fardeau économique
- Morbidité liée au paludisme
En 2016, le PSN 2016-2020 avait fixé comme objectif de réduire l’incidence du paludisme dans la population générale de 155‰ à 105‰ en 2019. Malgré les efforts fournis, l’incidence est en hausse passant de 155 à 191‰ dans la population générale et de 287 à 582‰ chez les enfants de moins de 5 ans de 2016 à 2019 (RASS 2016, 2017, 2018, 2019).
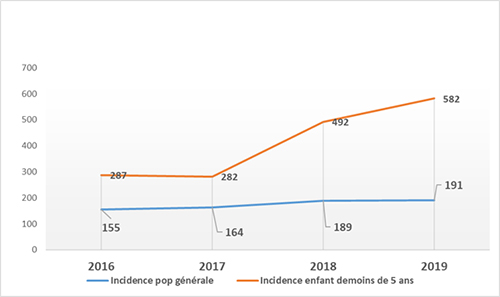
Figure 12 : Evolution de l’incidence de 2016 à 2019
L’augmentation de l’incidence en 2018 et en 2019 serait liée :
- au passage à échelle de la PECADOM/iCCM avec l’augmentation du recrutement des patients ;
- à la collecte des données du secteur privé lucratif (cliniques privées);
- au renforcement des consultations en stratégies avancées dans les quartiers précaires des grandes villes avec l’augmentation du nombre de sites.
- au double comptage des données communautaires et à l’intégration des cas présumés dans les cas de paludisme rapportés.
Le tableau VII ci-dessous montre une augmentation des cas de paludisme simple de 2016 à 2019. En revanche, les cas de paludisme grave diminuent sur la même période.
Tableau VII : Evolution des cas de paludisme, de 2016 à 2019
|
Indicateurs |
2016 |
2017 |
2018 |
2019 |
|
Nombre de cas de paludisme simple confirmés et traités |
4 152 065 |
4 642 614 |
4 821 749 |
|
|
Nombre de cas de paludisme grave confirmés et traités |
228 044 |
123 743 |
75 465 |
|
- Mortalité du paludisme
La mortalité liée au paludisme a connu globalement une baisse sur la période de mise en œuvre de 2016-2019.
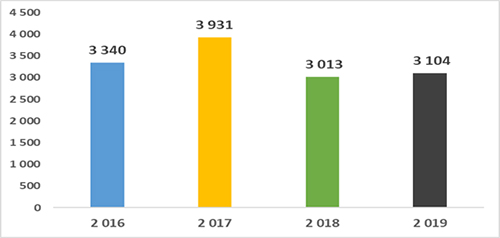
Figure 13 : Mortalité due au paludisme dans la population générale entre 2016- 2019
Le nombre de décès liés au paludisme dans la population générale a connu une régression passant de 3 340 décès en 2016 à 3104 en fin 2019.
Les variations constatées sur le nombre de décès liés au paludisme ces trois dernières années (2016, 2017, 2018), a conduit le PNLP en 2019 à diligenter un audit sur la notification des décès. Les résultats de cette étude ont révélé une différence entre les données de mortalité recueillies au niveau de la DIIS (7 205) et les données collectées dans les registres des hôpitaux de références enquêtées (1 364), soit une différence de 5 841 décès. L’analyse montre que sur les 1 364 décès enregistrés par les structures de références enquêtées comme étant des décès liés au paludisme de 2017 à 2018, seulement 229 patients décédés répondaient à la définition de décès dû au paludisme soit (17%). Les autres décès (1135 soit 83%) enregistrés étaient en rapport avec d’autres causes.
- Fardeau économique du paludisme
En Côte d’Ivoire la charge sociale et économique du paludisme est considérable pour les ménages et le pays. Selon les études, les coûts directs associés au paludisme représentent en moyenne 12 à 14% du revenu des ménages dont les membres actifs perdent en outre 4 à 7 jours de travail (A.S. Kouadio et al). Par ailleurs, l’étude conduite en 2010 dans les services médicaux du travail chez les travailleurs et les membres de leurs familles a révélé une prévalence du paludisme de 33%. Les salariés ont présenté 5 464 épisodes de paludisme qui ont justifié 121,33 mois d’absence. Le coût direct du paludisme représentait 213 223,85 euros (139 865 677 FCFA), l’absentéisme lié au paludisme à 64 738,33 euros (4 249 507 FCFA) et le coût de productivité à 933 042,73 euros (612 035 910 FCFA) (A.-F. Tchicaya et al.).



